

高中化学 sio2中si的杂化类型是什么?SiO2是空间网状结构,一个Si原子周围连有4个O原子。Si原子原子核外最外层有4个电子,恰好与氧原子形成4个σ键,无孤对电子。而杂化轨道用于形成σ键和容纳孤对电子。故SiO2中Si的杂化类型是sp3。而sp杂化是指该原子形成2个σ键而无孤对电子(如果同时形成π键不影响考虑杂化类型)。
晶体硅和sio2晶体中的si原子为什么也是sp3杂化你用1\/2{a-xb}这个公式计算。Si是+4价所以a=4,SiO2中的O有两个所以X=2,O在SiO2中现-2价所以b=2。你可以算出等于0.所以是sp3杂化。
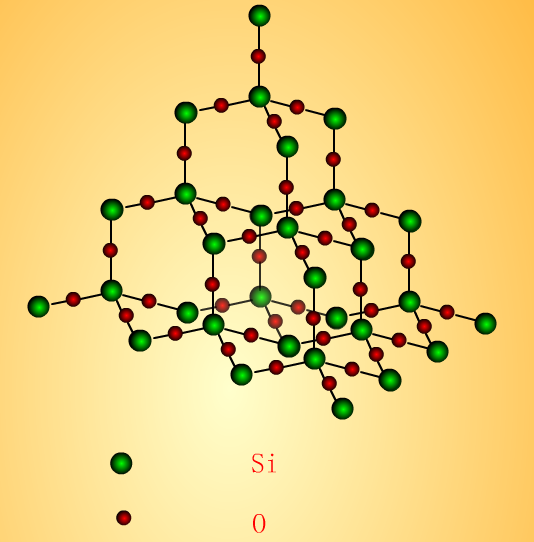
SiO2是什么晶体结构二氧化硅晶体中,Si原子均以sp3杂化,硅原子的4个价电子与4个氧原子形成4个共价键,硅原子位于正四面体的中心,4个氧原子位于正四面体的4个顶角上,SiO₂是表示组成的最简式,仅是表示二氧化硅晶体中硅和氧的原子个数之比。二氧化硅是原子晶体。二氧化硅晶体中的最小环为十二元环,其中有6个Si原...
SiO2中的Si 、 O 和H2O中的H、O分别采取什么杂化方式在SiO2中,硅(Si)原子采取等性sp3杂化,氧(O)原子则采取不等性sp3杂化。这种结构使得SiO2形成了一个空间网状结构,属于原子晶体。与二氧化碳(CO2)类似,硅原子与四个氧原子相连,每个氧原子又与两个硅原子相连,但SiO2实际上无法通过简单的电子式来描述,因为其结构是无限延伸的。相比之下,水(H2...
为什么SiO2的熔点高达1710℃,而CO2在通常情况下是气体?【答案】:因为在SiO2晶体中,Si原子采取的是sp3杂化,Si原子处于四面体中心,以共价键和处于四面体四个顶角上的氧原子键合,Si—O键在空间不断重复,构成巨型分子,键能很大,所以SiO2的熔点高达1710℃。在CO2分子中,C原子采取sp杂化,是线性分子,低温时,固体CO2晶体属于分子型晶体,每个CO2分子通过分子...
C与Si均为第四主族元素,试解释为什么SiO2的熔点高达1710℃,而CO2的熔 ...【答案】:因为SiO2中的Si原子采用sp3杂化轨道与四面体顶角上的O原子成键,si—O四面体在三维空间重复排列,构成巨型分子,其晶体为原子晶体,键能很大,所以SiO2熔点很高。而CO2中的C原子采用sp杂化轨道与O原子成键,形成非极性的CO2小分子,在低温时其晶体为分子晶体,分子间仅存在色散力,作用力较弱,...
二氧化硅的每个硅原子被几个环共有 是 12个 还是6个①二氧化硅中Si原子均以sp3杂化,分别与4个O原子成键,每个O原子与2个Si原子成键;②晶体中的最小环为十二元环,其中有6个Si原子和6个O原子,含有12个Si-O键;每个Si原子被12个十二元环共有,每个O原子被6个十二元环共有,每个Si-O键被6个十二元环共有;每个十二元环所拥有的Si原子数为6×...
二氧化硅的空间结构是怎么样的?二氧化硅是硅原子跟四个氧原子形成的四面体结构的原子晶体,整个晶体又可以看作是一个巨大分子,SiO2是最简式,并不表示单个分子。二氧化硅晶内Si原子均以sp3杂化,分别与4个O原子成键,构成Si-O四面体并占据四面体中心位置,配位数为4,O位于四面体的角顶。二氧化硅的用途 二氧化硅用途很广泛,主要用于制...
二氧化硅中硅的杂化方式是怎样的?二氧化硅中每个硅原子与四个氧原子形成四个Si-O,因此,Si的杂化方式是sp3杂化
二氧化硅的结构式怎样?二氧化硅是正四面体网状结构。Si结构类似于金刚石,每个Si原子以sp3杂化和其余3个Si原子形成Si—Si共价键,SiO2结构就是在Si空间结构的基础上,每两个Si原子之间以O原子连接。